乳癌
この記事は検証可能な参考文献や出典が全く示されていないか、不十分です。 出典を追加して記事の信頼性向上にご協力ください。(2018年10月) |
| 乳癌 | |
|---|---|
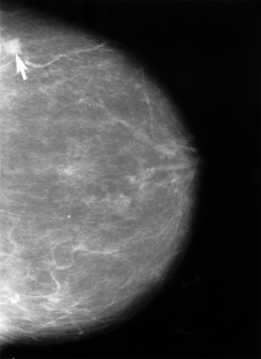 乳癌のX線画像(矢印) | |
| 分類および外部参照情報 | |
| 診療科・ 学術分野 | 腫瘍学 |
ICD-10 | C50 |
ICD-9-CM | 174-175,V10.3 |
| OMIM | 114480 |
| DiseasesDB | 1598 |
| MedlinePlus | 000913 |
| eMedicine | med/2808 med/3287 radio/115 plastic/521 |
| Patient UK | 乳癌 |
| MeSH | D001943 |
乳癌(にゅうがん、英: Breast cancer , 独:Brustkrebs, 羅:Carcinoma mamae)とは、乳房組織に発生した癌腫のことである。
目次
1 疫学
1.1 罹患の要因
1.2 予防
2 遺伝的負因
3 分類
4 症状
4.1 女性
4.2 男性
5 検診
6 検査
6.1 マンモグラフィー
6.2 超音波検査
6.3 腫瘍マーカー
6.4 病理診断
7 病期
8 治療
8.1 外科手術
8.2 根治的放射線療法(radical radiation therapy)
8.2.1 乳房温存療法
8.2.2 乳房温存療法の禁忌
8.2.3 乳房温存療法の成績
8.2.4 照射野
8.2.5 早期有害事象
8.2.6 晩期有害事象
8.2.7 治療スケジュール
8.3 緩和的放射線治療(palliative radiation therapy)
8.4 化学療法
9 予後
10 乳癌治療の歴史
11 患者数
11.1 2017年 (平成29年)日本における乳房の悪性新生物患者数
12 出典
13 参考文献
14 関連項目
15 外部リンク
疫学

2004年における10万人毎の乳癌による死亡者数(年齢標準化済み)[1]
データなし
2以下
2-4
4-6
6-8
8-10
10-12
12-14
14-16
16-18
18-20
20-22
22以上
世界中でよく見られる癌で、西側諸国では女性のおよそ10%が一生涯の間に乳癌罹患する機会を有する。それゆえ、早期発見と効果的な治療法を達成すべく膨大な労力が費やされている。また乳癌女性患者のおよそ20%がこの疾患で死亡する。
乳癌に罹患するリスクは年齢と共に増加する。生涯で乳癌に罹患する確率は、日本人女性で16人に1人、欧米では8〜10人に1人である。大阪府癌登録による成績では、1975〜2001年に診断された乳癌全罹患数(39,879例)のうち、男性乳癌は0.57%(226例)であった。また、Tajimaらは、男性乳癌の最頻値が60歳代であることを示した。[2][3]
罹患の要因
乳癌に罹患する確率は色々異なった要因で変わってくる。家系によっては、乳癌は遺伝的家系的なリスクが強い家系が存在する。人種によっては乳癌リスクの高いグループが存在し、アジア系に比べてヨーロッパ系とアフリカ系は乳癌リスクが高い。
他の明確になっているリスク要因としては以下の通り。
妊娠・出産歴がない。出産回数が少ない[4]。- 第一子出産の後、母乳を与えない。なお、関連がないとする報告もあり[4]。
- 初経年齢(月経が始まった年齢)が低い[4]。
- 閉経年齢が高い[4]。
ホルモン療法(エストロゲン製剤、ピルなど)を受けている。なお、関連がないとする報告もあり[4]。
飲酒[5]
喫煙[6](喫煙については、日本人を対象とした研究では、喫煙女性の乳癌リスクは、非喫煙者に比べて1.9倍となる[6]。)
- 高脂肪の食事
- 20歳時の体重が低いほど乳癌になりやすい。閉経後の女性では、成人後の体重の増加が多いほど乳癌になりやすい[7]。
シフト勤務による不規則な生活(IARC(国際がん研究機関)は、「サーカディアン・リズムを崩すシフト勤務」をグループ2A(ヒトに対する発癌性がおそらくあるもの)と2010年に報告している。主に前立腺がん、乳癌のリスクを高める可能性があるとしている[8]。)
ホジキンリンパ腫治療のためのマントル照射の既往
女性化乳房(男性の場合)
HPV感染
EBウイルス感染(インド[9]・中国[10][11]・北アフリカ[12][13]・南ヨーロッパ[14][15][16]にて、EBウイルスと乳癌との関連が指摘されていた。乳癌検体からのEBウイルス検出率としては約30%ほどである。2016年にはハーバード大学らの研究グループが、EBウイルスが乳腺上皮細胞に感染し、悪性形質転換させることを示している[17]。)

炎症性乳癌の病理組織像(D2-40染色)。
年齢と共に乳癌の発生する確率は高まるが、若年齢で発生した乳癌は活動的である傾向が存在する。乳癌の一種の炎症性乳癌 (Inflammatory Breast Cancer)は特に活動的で、若い女性に偏って発生し、初診時のステージがIIIbまたはIVであることが多い。この癌は他とは変わっていて、乳癌のしこりがないこともしばしば見受けられ、マンモグラフィーや超音波検査で発見することができない。乳腺炎(Mastitis)のような乳房の炎症が症状として現れる。

炎症性乳癌の病理組織像(HE染色)。腫瘍細胞はいずれもリンパ管侵襲として認められる。
予防
乳癌の予防の可能性の要素として次のようなものがある。
- 余暇運動への参加が多いほど、乳癌になりにくい。総身体活動量が高い女性は、閉経後においてホルモン受容体陽性の乳癌になりにくい。過体重の女性では、週1回以上の余暇運動に参加する人は、乳癌になりにくい[18]。
大豆イソフラボンであるゲニステインの血中濃度が高いグループの乳癌リスクは低い[19]。味噌汁の摂取が多いほど、乳癌になりにくい。大豆イソフラボンは乳癌発生率減少と関連している[20]。- 総野菜・総果物摂取量全体では、乳癌発生との関連は観察されなかったが、閉経前の女性では、「アブラナ科野菜」の摂取量が高いほど、乳癌になりにくいとの報告がある[21]。
- 閉経前女性では、マメ科植物、家禽類、ナッツ、魚類の摂取合計が、獣肉(レッド・ミート)摂取に対して多いと、乳癌の相対リスク低下が見られた[22]。
遺伝的負因
2つの遺伝子、BRCA1とBRCA2は家族性の乳癌と関連している。この家系の女性でこれらの遺伝子が発現している者はそうでない女性に比べて乳癌に罹患するリスクが極めて高い。(p53遺伝子突然変異の)Li-Fraumenid症候群もまた同様で、全乳癌患者の5%にこの症候群が見られる。他の遺伝因子は乳癌では散発的に見られるだけである。
分類
乳癌は、非浸潤乳管癌(ductal carcinoma in situ)、非浸潤性小葉癌(lobular carcinoma in situ)、浸潤乳管癌(invasive ductal carcinoma)に代表される浸潤癌、そしてPaget病に大別される。日本の乳癌取扱い規約では、浸潤乳管癌をさらに、乳頭腺管癌、充実腺管癌、硬癌に細分類する。
症状
女性
- 乳房のしこり、隆起(新たにできたもの)。圧痛がないとする成書もあるが、時に圧痛を伴うこともある。
- 乳房の陥凹(新たにできた「えくぼ」)。
- 乳汁分泌、血性乳汁。
- 脇の下のリンパ節を触れる。
など
男性
- 男性の場合、胸の異常発達(女性化乳房)が見られることもある。
- 男性の胸のしこりに関しては、雑菌の侵入による乳腺炎である場合も多く、乳癌の発症はレア・ケースである。「男性には発症しない」と誤解する人も多く、女性に比べて病気が進行してから受診して、治療開始が遅れる傾向がある。
- 日本乳癌学会で2015年に新たに登録された約8万7000人の乳癌患者のち男性は560人だった[23]。英国での男性乳癌患者の発生は、年250人と報告されている。
男性乳癌の頻度は少ないものの、女性では乳腺組織が脂肪に包まれており多少の浸潤であっても多臓器浸潤には至らないが、男性では表皮や胸壁に近接しており、わずかな浸潤でも容易に進行期となり得る。また女性に比べて治療などの情報入手や悩み相談などの機会が少ないため、NPO法人キャンサーネットジャパンが2018年から男性患者の交流会を開いている[23]。
検診
マンモグラフィー
30歳代から高齢の女性ほど罹患率が高いため、今日では多くの国で検診を受けることが推奨されている。検診には胸部自己診断法(breast self-examination) とマンモグラフィー(mammography) も含まれる。いくつかの国では、壮老年女性の全員の毎年のマンモグラフィー検診が実施され、早期乳癌の発見に効果を挙げている。ただし、検診にもデメリットは存在する。乳癌患者発見の背後には、その10倍以上の乳癌でない被験者が精密検査へと回り、生検(乳房に針を刺す)を受けていることも事実である。こういったことから、2009年にはアメリカの予防医学作業部会が40歳代の定期的なマンモグラフィ検診は推奨しないと発表し、大きな議論となった。
マンモグラフィーは早期乳癌を発見するための選択肢の一つであり、それだけで全ての年齢層に対して、全ての乳癌の早期発見がカバーできるものではない。欧米では生涯乳癌リスクが20%以上の女性に対して造影剤を用いたMRIによるスクリーニングが推奨されている。日本では現在、40歳代における超音波検査の併用検診の効果について大規模な臨床研究が行われている。CTはX線被曝や費用の問題もあり、検診に用いられることは希である。
20歳代での検査は、マンモグラフィ(描出率43%)よりも乳房超音波検査(描出率86%)が診断に有用である可能性が示唆された[24]。これは、若年者では乳腺が発達しており、マンモグラフィーで高輝度乳腺となって、病変を検知することができないという経験論とも合致し、年齢に応じた検査法の選択が必要であることを強く示唆する。なお、高齢者では、乳腺が萎縮しているためマンモグラフィーでも病変の描出が比較的容易である。
マンモグラフィーでの30歳代の乳癌症例における2 cm以下の触知癌の感度は78%(31/40例)と腫瘤に対する検出能力に関しては十分とはいえず,一方,超音波検査は触知腫瘤を全例検出していた[25]。NCCNの乳癌スクリーニング・診断ガイドラインでは腫瘤を触知する30歳未満の患者では、画像診断として超音波検査施行を勧め,腫瘤を触知しない異常乳頭分泌のある患者には超音波検査±マンモグラフィを勧めている[26]。
検査
壮老年女性の検診は増加しているのにも関わらず、多くの女性が乳癌に最初に気づくのは、かかりつけ開業医などが乳房のしこりを発見したり、入浴中にしこりを自覚したりといった契機による。
一般的な乳癌のスクリーニング検査としては、問診、触診、軟X線乳房撮影(マンモグラフィー)、超音波検査などが実施される。臨床的に疑いが生じると、乳房MRI検査および細胞診や生検、マンモトームなどが実施され病理学的診断により癌であるかどうか判別される。マンモグラフィは簡便であるが、早期乳癌の検出率は56%であり、MRIの検出率92%に有意に劣るとされる[27]。
細胞診は多くの場合、超音波装置の誘導で腫瘍内に細い針を挿入し腫瘍細胞を採取する。生検にはいくつかの種類があるが、超音波ガイド下にやや太目の針を挿入して腫瘍の一部を採取する針生検が最もスタンダードである。細胞診や針生検で診断が困難な場合には、超音波またはマンモグラフィーを取る機械を用いたマンモトーム生検、MRI検査でしか描出できない多発乳癌などの場合は、MRI検査をしながら生検を行うMRIガイド下乳腺生検が行われることもある。
マンモグラフィー
辺縁不正な腫瘤影、構築の乱れ、スピキュラ(spicula)、微細線状石灰化、微細分枝様石灰化が認められる。
- マンモグラフィ検診は、オランダにおいては乳癌による死亡を減少させなかった。またマンモグラフィ検診を受けなければ生涯を通じて検出されなかったであろう行き過ぎた乳癌過剰診断を増加させた。検診で見つかった乳癌の半数超(52%)は過剰診断乳癌と推定された。[28]
- 米国での75歳以上のマンモグラフィ検診では、0.80%に乳癌が発見された。76885人の受診者のうち、616人に乳癌が認められ、82%の病変が浸潤性乳癌であり、17人の患者は高齢であるか、または健康状態に問題があり外科的加療を受けなかった[29]との報告がある。
- マンモグラフィ検診は、オランダにおいては乳癌による死亡を減少させなかった。またマンモグラフィ検診を受けなければ生涯を通じて検出されなかったであろう行き過ぎた乳癌過剰診断を増加させた。検診で見つかった乳癌の半数超(52%)は過剰診断乳癌と推定された。[28]
超音波検査
形状不整、内部エコー不均一、後方エコー減弱などが認められる。
腫瘍マーカー
以下のものなどが使用される。がんの再発を100%検知できるものでもなければ、例えばCEAは喫煙によって高値を示すなど、感度・特異度とも完全な検査ではないため、CTなどの術後の定期検査も必要となってくる。以下に参考値も付すが検査機器によって正常値が異なるため、検査値の評価するときには、それを確認する必要がある。
- CEA(癌胎児性抗原: carcinoembryonic antigen):2.5 ng/ml以下
- CA15-3(carbohydrate antigen 15-3):30 U/ml以下
病理診断
病理医は普通、腫瘍の組織型と、顕微鏡的なレベルの進行度合い(浸潤性であるか否か、など)を生検の報告に記述している。浸潤性乳癌のほとんどは腺癌(adenocarcinoma)であり、その中で最も普通の亜型は浸潤性乳管癌 (infiltrating ductal carcinoma ICD-O code 8500/3)である。他の亜型としては浸潤性小葉癌 (infiltrating lobular carcinoma ICD-O code 8520/3)、髄様癌(medullary carcinoma)、粘液癌(mucinous carcinoma)、管状癌(tubular carcinoma)、浸潤性微小乳頭癌(invasive micropapillary carcinoma)、化生癌(metaplastic carcinoma)などがある。稀に、腺癌以外の癌腫(あるいは癌腫以外の悪性腫瘍)がみられる[30]。
また乳腺の増殖性病変の一部は乳癌と紛らわしい良性病変、良性と紛らわしい乳癌の顕微鏡像を呈することがあり、正しい診断に到達するためには、免疫染色という方法を用いることがある[31]。乳腺病理専門医にたいしてセカンドオピニオンを求めたり、針生検においては無理に最終診断を下さず切除生検を推奨したりすることも、時に重要となってくる。
診断が確定すると、次は癌の病期の判定に移る。腫瘍の広がり具合と、浸潤や転移の有無を、病期判定の尺度とする。
病期

硬癌
HER2/neuの過剰発現(免疫組織化学法)
乳癌の病期(ステージ)は腫瘍の乳房内での広がり、リンパ節への転移の有無、癌細胞の遠隔転移で決まってくる。腫瘍の乳房内での広がりには、腫瘍のサイズ、皮膚や胸壁への浸潤の有無、炎症性乳癌という病態かどうかが含まれる。浸潤・転移が疑われリスクが高い場合は、CTスキャン、骨(シンチグラフィー)、フルオロデオキシグルコース陽電子断層撮影(FDG-PET)、磁気共鳴画像(MRI)、血液検査などの追加の検査で、遠隔転移の発見が試みられる。
| 病 期 | 解説 |
|---|---|
0期 | 非浸潤がんといわれる乳管内にとどまっているがん、または乳頭部に発症するパジェット病(皮膚にできるがんの一種)で、極めて早期の乳がん。 |
I期 | しこりの大きさが2cm以下で、リンパ節や別の臓器には転移していない。 |
IIA期 | しこりの大きさが2cm以下で、わきの下のリンパ節に転移があり、そのリンパ節は周囲の組織に固定されず可動性がある。または、しこりの大きさが2〜5cmでリンパ節や別の臓器への転移がない。 |
IIB期 | しこりの大きさが2〜5cmで、わきの下のリンパ節に転移があり、そのリンパ節は周囲の組織に固定されず可動性がある。または、しこりの大きさが5cmを超えるが、リンパ節や別の臓器への転移がない。 |
IIIA期 | しこりの大きさが5cm以下で、わきの下のリンパ節に転移があり、そのリンパ節は周辺の組織に固定されている状態、またはリンパ節が互いに癒着している状態、またはわきの下のリンパ節転移がなく胸骨の内側のリンパ節に転移がある場合。あるいは、しこりの大きさが5cm以上で、わきの下または胸骨の内側のリンパ節への転移がある。 |
IIIB期 | しこりの大きさやリンパ節への転移の有無に関わらず、皮膚にしこりが顔を出したり皮膚が崩れたり皮膚がむくんでいるような状態。 |
IIIC期 | しこりの大きさに関わらず、わきの下のリンパ節と胸骨の内側のリンパ節の両方に転移がある、または鎖骨の上下にあるリンパ節に転移がある。 |
IV期 | 別の臓器に転移している。 |
※ 「国立がん研究センター がん情報サービス」の胃がんの病期(ステージ)分類表[32]より引用し改変。
治療
乳癌の治療は原則的には外科的切除であり、抗がん剤や抗エストロゲン剤など化学療法と放射線療法が併用される。術前に化学療法を行なうことをneo-adjuvant治療といい、術後に行なうことをadjuvant治療と呼ぶ。化学療法への腫瘍細胞の反応は様々で、術前化学療法で病理組織検査上、がん細胞が完全に死滅することもあるが、この場合でも、温存術後の放射線治療は省略すべきでないとされている。ただし、化学療法にも放射線療法にも副作用は必発であるし、手術の場合も術後合併症が起こることもある点などに考慮を要する。
外科手術
手術Stage I〜III Aに対して適応となる。最近では、乳房温存術と乳房切除術とでは予後に差がないことが報告されてきており、手術は拡大手術ではなく縮小手術が行われる傾向にある。
- 乳房温存術(lumpectomy 腫瘤のみを摘出 乳腺腫瘤摘出術)
- 乳房切除術(mastectomy 乳房を切除ないし完全に切除する)
- 胸筋合併乳房切除術
- 胸筋温存乳房切除術
腫瘤の大きさによって切除範囲が選択されるため、>3cm以上の大きな腫瘤や、胸壁や皮膚へ直接浸潤しているような進行している場合には広範囲切除となる。切除断端陽性(遺残)が再発の高リスクであるため、できる限りの腫瘤摘出が望まれる。
手術の際には、リンパ節郭清として、センチネルリンパ節生検(sentinel lymph node biopsy)が行われ、リンパ節転移のある場合には状況によりセンチネルリンパ節のサンプリングだけで終わるか、腋窩リンパ節郭清を行なうか判断される。なお、乳房を直接切り開いて腫瘍を摘出する場合のほか、内視鏡を使用して摘出する場合もある[33]。
根治的放射線療法(radical radiation therapy)
乳房温存療法
温存術後に放射線治療を組み合わせた治療法を「乳房温存療法(breast conservative treatment)」といい、局所再発率といった治療成績は乳房全摘術(amptation of the breast)と同等である。
乳房温存療法の禁忌
ただし、胸部照射の既往や活動性の強皮症や全身性エリテマトーデス(systemic lupus erythematosus)をはじめとする膠原病の合併、妊娠中などいくつかの禁忌が存在する。また、放射線治療時には両手を挙上する必要があるがこの体位を保持できない場合にも、温存療法の適応とならない。
乳房温存療法の成績
乳房温存術後の局所再発の予防を目的とした乳房全照射が一般に行なわれ、術後照射により局所再発が1⁄3から1⁄4に減るとする文献もあり、大規模な研究によれば、生存期間を延ばすという効果も認められている。
照射野
照射野は通常、患側乳房全体であるが、腋窩リンパ節転移が主に4個以上あれば、鎖骨上窩リンパ節領域への予防照射も検討され、術前の画像上、胸骨傍リンパ節転移を疑う場合には同部位も照射野に入れる。
乳房温存術後の予防照射としては、全乳房に対して50Gy/25fr(一回に2Gy(グレイ)という放射線量を25回照射し、総線量50Gy照射)照射するのが、一般的である。術後断端が陽性(顕微鏡レベルではあるが、手術で癌を取り切れていなかった可能性が高い)である場合などは、癌が元あった場所(腫瘍床)に10Gy/5fr追加で照射することもある(ブースト照射)。
早期有害事象
術後の予防照射では、皮膚の発赤や茶褐色の着色、乾燥、かゆみ、術創部付近のぴりぴり感などの急性の有害事象が生じることが多いものの、概して軽度に治まり、徐々に(一年程度)、照射による変化は消失していく。
晩期有害事象
一方、患側の手の浮腫は手術によるリンパ節郭清の影響と相俟って、強く出ることもあり、これは鎖骨上窩リンパ節照射を照射することによって、出現頻度が高まり、まだ症状も強い傾向にある。一旦浮腫が起こると治療することが難しいため、ならないように生活指導されるが、重いものを持たないなど患側の手を愛護的に扱うといった事が中心である。しかし、患側が利き手であるとこうしたことは難しく、研究結果とともに患者の今後の生活まで視野に入れた治療方針を決定することが重要である。また、左乳癌の場合、心臓もわずかに照射野に入るため、心膜炎、狭心症、心筋梗塞といった有害事象も生じうる。さらに、放射線による二次発癌も懸念される。
治療スケジュール
25回の照射は、通常土曜日、日曜日、祝日を除いて毎日連続で行なうことが必要であり、一ヶ月と少しは毎日病院に来る必要があって、通院が負担となる例もある。そのため短期照射といって、25回よりも短い期間で同様の効果が得られる放射線治療法が健康保険でも認められており、利用されている。ただし、短期照射では、総線量が50Gyに満たない。民間の医療保険では、放射線治療を行なった場合、50Gy以上の照射でなければ、保険金が出ないという契約となっていることも多く、短期照射を希望する場合は確認が必要である。
また、小線源治療などにより、乳房全体ではなく、腫瘍があった部分に限局して放射線を照射するという研究もなされており、結果が待たれる。
緩和的放射線治療(palliative radiation therapy)
転移および再発における症状緩和を目的とした照射がある。乳癌は比較的骨転移を来しやすい癌腫である。骨転移は無症状の場合もあるが、強い疼痛を伴うこともあり、こうした場合に病変部に照射すると、9割程度で除痛効果が得られ、半数では完全に痛みが消失する。背骨(脊椎)に転移すると、脊髄という神経の束を圧迫して、麻痺などを起こすこともあるが、放射線照射で癌を制御することにより、麻痺が解除されうる。また、脳転移も時に認められるが、数が少なければ定位放射線治療を行なったり、多ければ全脳照射を行なったりする。
他、肝臓や、肺にも転移しやすく、少数であれば定位放射線治療の適応もあるが、一般に化学療法などの全身療法をすることが多い。
化学療法
術後化学療法は再発リスク評価に応じて適用され、内分泌薬、抗がん剤、分子標的治療薬の3種類を用いて行われる。また術前化学療法も行われる。また再発・転移性乳癌においても化学療法が行われる。
- 内分泌薬
- 乳癌はエストロゲン依存性であることが多いことから、エストロゲン受容体(ER)、プロゲステロン受容体(PgR)の発現の高いものは内分泌薬が奏功する。
- 抗エストロゲン薬:タモキシフェン
- アロマターゼ阻害薬:アナストロゾール、エキセメスタン、レトロゾール
- LH-RH作用薬:
- 抗エストロゲン薬:タモキシフェン
閉経前後で以下の通りに行われる。
閉経前女性:抗エストロゲン薬+LH-RH作用薬
閉経後女性:抗エストロゲン薬 or アロマターゼ阻害薬
- 抗がん剤
- 以下の通りに行われる。基本的にER/PgR発現の低いもの(陰性)の場合に行われる。
- CMF(シクロホスファミド+メソトレキセート+フルオロウラシル)
- CAF(シクロホスファミド+アドリアシン+フルオロウラシル)
- AC(アントラサイクリン系:ドキソルビシン+シクロホスファミド)
- 分子標的治療
- ヒト上皮成長因子受容体2(HER-2)陽性の場合、分子標的治療薬が奏功する。
トラスツズマブ:HER-2モノクローナル抗体
ラパチニブ:EGFR・HER-2低分子阻害薬
BRCA1/2変異陽性の場合、PARP阻害剤が奏功する。
オラパリブ : PARP阻害剤
mTOR阻害剤
エベロリムス[34]
予後
長期治療成績は診断確定時の乳癌の病期(ステージ)と癌がどのように治療されたかに依存する。一般的に言って、早期発見されればされるほど予後は良い。早期であればほとんどの乳癌が手術によって根治する。男性乳癌では女性乳癌と比較して大胸筋浸潤を起こしやすく、進行癌で発見される確率が高いため、5年生存率40〜50%と予後不良であると考えられてきた。しかしながら、近年の例によると女性患者と比べても全生存率、無病生存率ともに変わらないことが指摘されている[35]。
また、外科的手術を行った場合、主に審美的な観点、および、患者の精神的なケアの観点から、乳房再建術が行われることがある。さらに再建後の乳房に適したブラジャーの相談対応やオーダーメードも行われている[36]。
乳癌治療の歴史
乳癌は古代からあった病気で、古代エジプトにおいてはイムフォテプと言う医師による乳癌治療の記録がパピルス文書に残されている(紀元前3000年 - 紀元前5000年のこと)。
古代における乳癌の主な治療方法は、乳房の一部を切開することで悪性腫瘍を排膿し、残りの腫瘍は原始的に焼却したり腐敗させたりした。古代においては麻酔も防腐もない時代であるので、乳癌の手術には大変な苦痛が伴い、手に負えないものであれば軟膏を塗るといった姑息的な手法によるしかできなかった。
それから長い時代において、乳癌治療の歴史[37] は停滞したままであったが、16世紀にアンブロワーズ・パレという外科医が、糸による結紮(けっさつ)で細胞を壊死(えし)させ、それによって癌を取り除くという手法を試みた。乳癌の手術技法を確立したのは、フランスの外科医、ジャン=ルイ・プティ(1674年〜1750年)である。その方法は、癌に周囲組織を大きく付けて一塊にして切り取り、さらに転移を防ぐために腋窩(えきか)リンパ節を取るものであり、これは現代の外科の考えと一致するものである。彼の死後24年後にはその業績は出版され、1800年代に入ってからは多くの外科医が乳癌治療の腕を競うようになった。
今日の乳癌手術の術式を確立したのはW・S・ハルステッドであり、1970年代まで彼の確立した術式は世界中で認められ、用いられるようになった。ハルステッドは1882年、最初の根治的乳房切断手術を行った。これまでの手術と違う所は、癌腫瘤から大きく離して正常皮膚乳腺組織を大きく癌の癌腫瘤の側に付けて切除し、さらに大胸筋と腋窩リンパ節を摘除していることである。
メイヤーは1894年、6例の根治的乳房切断術を行ったことを報告している。彼は大胸筋のみでなく、より安全を確保するために小胸筋も切除した。こうして乳癌根治術方が確立されることとなった。乳癌は乳房を切除しても皮膚は腋窩に癌が再発することが多かったが、ハルステッドの療法によって、それまでの再発率60〜70%が6%に劇的に抑えられるようになった。
患者数
2017年 (平成29年)日本における乳房の悪性新生物患者数
厚生労働省平成29年患者調査による[38]
| 年齢 | 総患者数 | 男性 | 女性 |
|---|---|---|---|
| 0歳 | 0 | 0 | 0 |
| 1-4 | 0 | 0 | - |
| 5-9 | - | - | - |
| 10-14 | 0 | 0 | - |
| 15-19 | 0 | - | 0 |
| 20-24 | 0 | 0 | 0 |
| 25-29 | 1 | 0 | 1 |
| 30-34 | 2 | - | 2 |
| 35-39 | 5 | 0 | 5 |
| 40-44 | 11 | 0 | 11 |
| 45-49 | 24 | 0 | 24 |
| 50-54 | 26 | 0 | 26 |
| 55-59 | 23 | 0 | 23 |
| 60-64 | 26 | 0 | 26 |
| 65-69 | 33 | 0 | 33 |
| 70-74 | 26 | 0 | 26 |
| 75-79 | 24 | 1 | 23 |
| 80-84 | 16 | 0 | 16 |
| 85-89 | 10 | 0 | 9 |
| 90歳以上 | 5 | 0 | 5 |
| 不詳 | 0 | - | 0 |
| 合計 | 232 | 3 | 229 |
出典
^ “WHO Disease and injury country estimates”. World Health Organization (2009年). 2009年11月11日閲覧。
^ よくわかる乳癌のすべて,飯野祐介,永井書店, p.27
^ tajima N, et al.,Descriptive epidemiology of male breast cancer in Osaka, Japan. J Epidemiol :1-7, 2001, doi:10.2188/jea.11.1
- ^ abcde生理・生殖要因と乳がん罹患の関連について - 独立行政法人 国立がん研究センター(がん予防・検診研究センター 予防研究部)
^ 飲酒と乳がん罹患との関係について - 独立行政法人 国立がん研究センター(がん予防・検診研究センター 予防研究部)
- ^ ab喫煙・受動喫煙と乳がん発生率との関係について - 独立行政法人 国立がん研究センター(がん予防・検診研究センター 予防研究部)
^ 20歳時体重、成人後の体重の変化と乳がん - 独立行政法人 国立がん研究センター(がん予防・検診研究センター 予防研究部)
^ Shift Work - IARC Monographs、2010年、国際がん研究機関(IARC)、2016年7月18日閲覧
^ Joshi D, Quadri M, Gangane N, Joshi R, Gangane N (2009). "Association of Epstein Barr virus infection (EBV) with breast cancer in rural Indian women". ProS One. 4 (12): e8180., PMC: 2782138, .mw-parser-output cite.citation{font-style:inherit}.mw-parser-output .citation q{quotes:"""""""'""'"}.mw-parser-output .citation .cs1-lock-free a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/6/65/Lock-green.svg/9px-Lock-green.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output .citation .cs1-lock-limited a,.mw-parser-output .citation .cs1-lock-registration a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/d/d6/Lock-gray-alt-2.svg/9px-Lock-gray-alt-2.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output .citation .cs1-lock-subscription a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/a/aa/Lock-red-alt-2.svg/9px-Lock-red-alt-2.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registration{color:#555}.mw-parser-output .cs1-subscription span,.mw-parser-output .cs1-registration span{border-bottom:1px dotted;cursor:help}.mw-parser-output .cs1-ws-icon a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/4/4c/Wikisource-logo.svg/12px-Wikisource-logo.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output code.cs1-code{color:inherit;background:inherit;border:inherit;padding:inherit}.mw-parser-output .cs1-hidden-error{display:none;font-size:100%}.mw-parser-output .cs1-visible-error{font-size:100%}.mw-parser-output .cs1-maint{display:none;color:#33aa33;margin-left:0.3em}.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registration,.mw-parser-output .cs1-format{font-size:95%}.mw-parser-output .cs1-kern-left,.mw-parser-output .cs1-kern-wl-left{padding-left:0.2em}.mw-parser-output .cs1-kern-right,.mw-parser-output .cs1-kern-wl-right{padding-right:0.2em}
PMID 19997605, doi:10.1371/journal.pone.0008180.
^ He JR, Chen LJ, Su Y, Cen YL, Tang LY, Yu DD, Chen WQ, Wang SM, Song EW, Ren ZF (2012). "Joint effects of Epstein-Barr virus and polymorphisms in interleukin-10 and interferon-γ on breast cancer risk". The Journal of Infectious Disease. 205 (1): 64-71.,
PMID 22095765, doi:10.1093/infdis/jir710.
^ Peng J, Wang T, Zhu H, Guo J, Li K, Yao Q, Lv Y, Zhang J, He C, Chen J, Wang L, Jin Q (2014). "Multiplex PCR/mass spectrometry screening of biological carcinogenic agents in human mammary tumors". Journal of Clinical Virology. 61 (2): 255-9.,
PMID 25088618, doi:10.1016/j.jcv.2014.07.010.
^ Fina F, Romain S, Ouafik L, Palmari J, Ben Ayed F, Benharkat S, Bonnier P, Spyratos F, Foekens JA, Rose C, Buisson M, Gérard H, Reymond MO, Seigneurin JM, Martin PM (2001). "Frequency and genome load of Epstein-Barr virus in 509 breast cancers from different geographical areas". British Journal of Cancer. 84 (6): 783-90., PMC: 2363823,
PMID 11259092, doi:10.1054/bjoc.2000.1672.
^ Hachana M, Amara K, Ziadi S, Romdhane E, Gacem RB, Trimeche M (2011). "Investigation of Epstein-Barr virus in breast carcinomas in Tunisia". Pathology - Research and Practice. 207 (11): 695-700.,
PMID 22024152, doi:10.1016/j.prp.2011.09.007.
^ Labrecque LG, Barnes DM, Fentiman IS, Griffin BE (1995). "Epstein–Barr virus in epithelial cell tumors: a breast cancer study". Cancer Research. 55 (1): 39-45.,
PMID 7805038, full text.
^ Mazouni C, Fina F, Romain S, Ouafik L, Bonnier P, Brandone JM, Martin PM (2011). "Epstein–Barr virus as a marker of biological aggressiveness in breast cancer". British Journal of Cancer. 104(2): 332-7., PMC: 3031896,
PMID 21179039, doi:10.1038/sj.bjc.6606048.
^ Marrão G, Habib M, Paiva A, Bicout D, Fallecker C, Franco S, Fafi-Kremer S, Simões da Silva T, Morand P, Freire de Oliveira C, Drouet E (2014). "Epstein–Barr virus infection and clinical outcome in breast cancer patients correlate with immune cell TNF-alpha/IFN-gamma response". BMC Cancer. 14: 665., PMC: 4171567,
PMID 25213133, doi:10.1186/1471-2407-14-665.
^ Hu H, Luo ML, Desmedt C, Nabavi S, Yadegarynia S, Hong A, Konstantinopoulos PA, Gabrielson E, Hines-Boykin R, Pihan G, Yuan X, Sotirious C, Dittmer DP, Fingeroth JD, Wulf GM (2016). "Epstein-Barr Virus Infection of Mammary Epithelial Cells Promotes Malignant Transformation". EBioMedicine. 9: 148-60., PMC: 4972522,
PMID 27333046, doi:10.1016/j.ebiom.2016.05.025.
^ 余暇運動と乳がん - 独立行政法人 国立がん研究センター(がん予防・検診研究センター 予防研究部)
^ 血中イソフラボン濃度と乳がん罹患との関係について - 独立行政法人 国立がん研究センター(がん予防・検診研究センター 予防研究部)
^ 大豆・イソフラボン摂取と乳がん発生率との関係について - 独立行政法人 国立がん研究センター(がん予防・検診研究センター 予防研究部)
^ 野菜・果物摂取と乳がん罹患との関連について - 独立行政法人 国立がん研究センター(がん予防・検診研究センター 予防研究部)
^ Dietary protein sources in early adulthood and breast cancer incidence: prospective cohort study. BMJ 2014; 348 doi:10.1136/bmj.g3437
- ^ ab男性にもある乳がん 支援団体が交流会/少ない情報 特有の悩み『埼玉新聞』2018年2月7日(15面)。
^ 小倉拓也 他, 第19回日本乳癌学会学術総会, 2011
^ Osako T, et al. Diagnostic mammography and ultrasonography for palpable and nonpalpable breast cancer in women aged 30 to 39 years. Breast Cancer. 2007;14(3):255-9.
^ https://jbcs.gr.jp/guidline/guideline/g5/g51700/
^ Kuhl CK, et al. MRI for diagnosis of pure ductal carcinoma in situ: a prospective observational study. Lancet. 2007; 370(9586): 485-92., doi:10.1016/S0140-6736(07)61232-X
^ Effectiveness of and overdiagnosis from mammography screening in the Netherlands: population based study. BMJ 2017;359:j5224
^ https://www.rsna.org/en/news/2018/November-December/mammography-beyond-age-75
^ Robbins and Cotran Pathologic Basis of Disease 8the edition p1079-1089
^ http://ganjoho.ncc.go.jp/professional/med_info/surgical_pathology/breast_papillary_lesion.html[リンク切れ]
^ 乳がんの病期(ステージ)分類 国立がん研究センター がん情報サービス
^ 乳房にキズをつけない乳がん手術
^ mTOR阻害剤エベロリムスが乳癌に適応拡大
^ (旧版)科学的根拠に基づく 乳癌診療ガイドライン 1 薬物療法 2004年版
^ 乳がん 再建後も私らしいブラを/岡山大病院「やっとおっぱいと再会できた」『朝日新聞』夕刊2018年11月17日(1面)2018年11月20日閲覧。
^ 参考書籍『癌の歴史』(著:P.ダルモン 版:新評論 刊:1997年)
^ “患者調査 43 推計退院患者数,性・年齢階級 × 傷病大分類 × 病院-一般診療所別 (公開用データ)”. 政府統計の総合窓口. 総務省統計局. 2019年3月21日閲覧。
参考文献
出典は列挙するだけでなく、脚注などを用いてどの記述の情報源であるかを明記してください。記事の信頼性向上にご協力をお願いいたします。(2015年3月) |
- 『科学的根拠に基づく 乳癌診療ガイドライン2004年版』 日本乳癌学会 編、金原書店、2004年7月。
ISBN 978-4307201902。
関連項目
- 腫瘍学
悪性腫瘍
- 乳腺外科
- 乳房再建
- 産婦人科学
華岡青洲 - 1804年に世界初の全身麻酔下における乳癌摘出手術を実施。
ピンクリボン - 乳癌やその検診に関する世界規模の啓発キャンペーン。
余命一ヶ月の花嫁 - 24歳で末期の乳癌と診断された女性のドキュメンタリー番組。
外部リンク
“乳がんの情報”. がん情報サイト Cancer Information Japan. 先端医療振興財団 臨床研究情報センター. 2015年3月11日閲覧。 - 米国国立がん研究所が発行するPDQ(Physician Data Query)の日本語版。
(関連団体)
- “日本乳癌学会”. 2015年3月11日閲覧。
- “独立行政法人 国立がんセンター”. 2015年3月11日閲覧。
- “公益財団法人 がん研究会”. 2015年3月11日閲覧。
- “公益財団法人 日本対がん協会”. 2015年3月11日閲覧。
- “特定非営利活動法人 日本乳がん検診精度管理中央機構”. 2019年3月18日閲覧。

