アミノ酸

グリシンの構造式。最も構造が単純なアミノ酸

トリプトファンの構造式。最も構造が複雑なアミノ酸の1つ。
アミノ酸(アミノさん、英: amino acid)とは、広義には(特に化学の分野では)、アミノ基とカルボキシル基の両方の官能基を持つ有機化合物の総称である。一方、狭義には(特に生化学の分野やその他より一般的な場合には)、生体のタンパク質の構成ユニットとなる「α-アミノ酸」を指す。分子生物学など、生体分子をあつかう生命科学分野においては、遺伝暗号表に含まれるプロリン(イミノ酸に分類される)を、便宜上アミノ酸に含めることが多い[1][2]。
天然には約500種類ほどのアミノ酸が見つかっている[3]が、宇宙由来のものとしても1969年に見つかったマーチソン隕石からグリシン、アラニン、グルタミン酸、β-アラニンが確認されている[3]。全アミノ酸のうち22種がタンパク質の構成要素であり、真核生物では21種から、ヒトでは20種から構成される。動物が体内で合成できないアミノ酸を、その種にとっての必須アミノ酸と呼び、動物種によって異なるが[4]、ヒトでは9種類のアミノ酸は食事により摂取しなければならない。
必須でないアミノ酸(可欠アミノ酸)も、摂取バランスによっては代謝異常や欠乏を起こすことがある。非天然のアミノ酸はキラルビルディングブロック(光学活性化合物から有用な生化合物を合成する手法)、複雑な分子の構造解析、分子スキャフォー ルド(細胞培養における基質のことで「足場」の意味)、さらには人工タンパク質の合成などにも利用されている。
必須アミノ酸とタンパク質が密接に関わっているため、便宜的に(必須)アミノ酸を三大栄養素のタンパク質の代わりとすることもある。
目次
1 構造
2 分類
3 タンパク質を構成するアミノ酸
4 その他のアミノ酸
5 アミノ酸の合成
5.1 ユーリー・ミラーの実験
5.2 現代の実用的アミノ酸合成
6 摂取状況
7 サプリメント
8 関連項目
9 脚注
構造
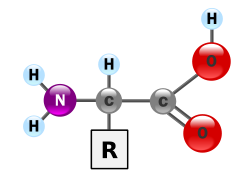
α-アミノ酸の一般構造式
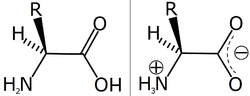
アミノ酸の構造(左)と双性イオン(右)
α-アミノ酸とは、カルボキシル基が結合している炭素(α炭素)にアミノ基も結合しているアミノ酸であり、RCH(NH2)COOH という構造を持つ。Rが水素 (H) であるグリシン以外のα-アミノ酸では、α炭素へのアミノ基やカルボキシル基などの結合様式が立体的に2通り可能で、それぞれ、D型、L型の光学異性体として区別される。生体のタンパク質はα-アミノ酸のポリマーであるが、基本的にL型のものだけが構成成分となっている。D型は天然では細菌の細胞壁の構成成分や老化組織、ある種の神経細胞などに存在が見出されている。生体のタンパク質はほとんどの場合、Rで表記した側鎖の違いによる20種類のアミノ酸からなる。個々のアミノ酸はこの側鎖の性質によって、親水性・疎水性、塩基性・酸性などの性質が異なる。
分類
- 側鎖による分類
分岐鎖アミノ酸、芳香族アミノ酸、含硫アミノ酸
- 代謝物による分類
糖原性アミノ酸、ケト原性アミノ酸
- アミノ基の位置による分類
- α-アミノ酸 例:アラニン
- β-アミノ酸 例:β-アラニン
- γ-アミノ酸 例:γ-アミノ酪酸
- δ-アミノ酸 例:δ-アミノ吉草酸
- 光学異性による分類
D-アミノ酸、L-アミノ酸
- 栄養学上の分類
2005年米国医学研究所発行の書籍によれば以下のように分類している。[5]
必須アミノ酸
ヒスチジン、イソロイシン、ロイシン、リシン、メチオニン、フェニルアラニン、トレオニン、トリプトファン、バリン
条件付き必須アミノ酸
- 体内の代謝だけでは必要量を十分には賄えないことがあるアミノ酸。
アルギニン、システイン、グルタミン、グリシン、プロリン、チロシン
非必須アミノ酸
アラニン、アスパラギン酸、アスパラギン、グルタミン酸、セリン
タンパク質を構成するアミノ酸
一部の特殊なものを除き、タンパク質は20種類のアミノ酸が結合して作られている。これらのアミノ酸にはそれぞれ一文字表記、または三文字表記のアルファベットからなる略号が付与されており、一次構造の記述に使用される。
それぞれのアミノ酸は、構造によって異なる酸・塩基性を持つ。構造内に2つのカルボキシル基を持つアミノ酸(アスパラギン酸およびグルタミン酸)は酸性を、2つ以上のアミノ基を持つアミノ酸(リシン・アルギニン・ヒスチジン)は塩基性を、その他のアミノ酸はほぼ中性を示す。また、それぞれのアミノ酸は等電点が実験的に決定されており、電気泳動などの分離時に意味を持つ。
中性アミノ酸は、カルボキシル基およびアミノ基以外に持つ特徴的な基によって、幾つかに分類される。主に、アルキル鎖を持つグリシン・アラニン・バリン・ロイシン・イソロイシン、ヒドロキシ基を持つセリン・トレオニン、硫黄を含むシステイン・メチオニン、アミド基を持つアスパラギン・グルタミン、イミノ基を持つプロリン、芳香族基を持つフェニルアラニン・チロシン・トリプトファンに分類され、タンパク質の持つ疎水性や立体配座はこれらの分類を考慮しながら考察される。
| アミノ酸 | 三文字表記 | 一文字表記 | 構造式 | コドン (IUPAC 通知) | 分子量 | 等電点 | ファンデルワールス半径 | タンパク質の豊富(%)[6] |
|---|---|---|---|---|---|---|---|---|
| アラニン | Ala | A |  | GCN | 89.09 | 6.00 | 67 | 8.76 |
| アルギニン | Arg | R | 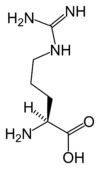 | MGN, CGY (時々CGN、AGR) | 174.20 | 10.76 | 148 | 5.78 |
| アスパラギン | Asn | N |  | AAY | 132.12 | 5.41 | 96 | 3.93 |
| アスパラギン酸 | Asp | D |  | GAY | 133.10 | 2.77 | 91 | 5.49 |
| システイン | Cys | C |  | UGY | 121.16 | 5.05 | 86 | 1.38 |
| グルタミン | Gln | Q |  | CAR | 146.15 | 5.65 | 114 | 3.9 |
| グルタミン酸 | Glu | E |  | GAR | 147.13 | 3.22 | 109 | 6.32 |
| グリシン | Gly | G |  | GGN | 75.07 | 5.97 | 48 | 7.03 |
| ヒスチジン | His | H |  | CAY | 155.15 | 7.59 | 118 | 2.26 |
| イソロイシン | Ile | I | 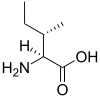 | AUH | 131.17 | 6.05 | 124 | 5.49 |
| ロイシン | Leu | L |  | YUR, CUY (時々UUR、CUN) | 131.17 | 5.98 | 124 | 9.68 |
| リシン | Lys | K |  | AAR | 146.19 | 9.75 | 135 | 5.19 |
| メチオニン | Met | M |  | AUG | 149.21 | 5.74 | 124 | 2.32 |
| フェニルアラニン | Phe | F |  | UUY | 165.19 | 5.48 | 135 | 3.87 |
| プロリン | Pro | P |  | CCN | 115.13 | 6.30 | 90 | 5.02 |
| セリン | Ser | S | 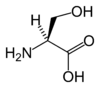 | UCN, AGY | 105.09 | 5.68 | 73 | 7.14 |
| トレオニン | Thr | T |  | ACN | 119.12 | 6.16 | 93 | 5.53 |
| トリプトファン | Trp | W |  | UGG | 204.23 | 5.89 | 163 | 1.25 |
| チロシン | Tyr | Y |  | UAY | 181.19 | 5.66 | 141 | 2.91 |
| バリン | Val | V | 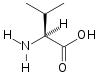 | GUN | 117.15 | 5.96 | 105 | 6.73 |
上に挙げた20種類のアミノ酸は、タンパク質合成時に遺伝情報に基づいて連結される。多くのタンパク質は上記の20種類のアミノ酸残基からなるが、ある種のタンパク質にはセレノシステイン残基、N-ホルミルメチオニン残基、ピロリシン残基、ピログルタミン酸残基などの特殊なものも含まれる。
上記のほかにタンパク質合成後に修飾を受けるアミノ酸残基も存在する[7][8]。例えば以下のようなものである。
シスチン — システイン2分子が酸化されて生成する。
ヒドロキシプロリン、ヒドロキシリシン — ゼラチン、コラーゲンに含まれる。
サイロキシン — 甲状腺タンパク質に含まれる。
O-ホスホセリン — カゼインなど、多くのリンタンパク質に含まれる。
デスモシン — エラスチンやコラーゲンに含まれる。
タンパク質に含まれないアミノ酸として、以下のようなものも存在する(こうしたアミノ酸を総称して異常アミノ酸と呼ぶこともあるが、必ずしも適切な命名ではないという批判もある)。
β-アラニン — 筋肉中に存在する。
サルコシン — ある種の抗生物質に含まれる。N-メチルグリシンに相当する。
オルニチン — 尿素回路の中間体。
シトルリン — 尿素回路の中間体。
クレアチン — 筋肉中に存在する。
γ-アミノ酪酸 — 神経伝達物質。GABA とも呼ばれる。
オパイン — アグロバクテリウムのエネルギー源に利用される。
トリメチルグリシン —
その他のアミノ酸
天然に産する広義のアミノ酸の中には、旨み成分や、薬物として作用するもの、そして毒となるものがある。
テアニン — 茶の旨み成分。
トリコロミン酸 — ハエトリシメジの旨み成分。
カイニン酸 — 海人草の薬用成分。
ドウモイ酸 — 記憶喪失性貝毒の毒成分。
イボテン酸 — テングタケなどの毒成分。
アクロメリン酸 — ドクササコの毒成分。
アミノ酸の合成
ユーリー・ミラーの実験
1953年、シカゴ大学のハロルド・ユーリーとスタンリー・ミラーは、アンモニア・メタン・水素の混合ガス(当時原始大気成分と考えられていた)と水の入った容器に電気火花を飛ばす実験を行い、グリシン・アラニン・アスパラギン酸などの各種アミノ酸が生成することを発見した(ユーリー・ミラーの実験)。原始地球において、生命の素材となったアミノ酸が生成した過程の可能性を示した、有名な実験である[9][10]。
現代の実用的アミノ酸合成
いわゆる異常アミノ酸の中にも重要な生理活性を持つものは数多く存在し、また医薬にもD体または非天然型のアミノ酸は数多く使われている。このためアミノ酸の合成(特に不斉合成)は需要が高く、種々の方法が提案されている。
古くから用いられているアミノ酸の合成法としてストレッカー反応がある。アルデヒドとアンモニア・シアン化水素の3成分縮合によってα-アミノニトリルを合成し、この加水分解によりアミノ酸を得るというものである。
他にα-ハロカルボン酸とアミンの反応、グリシンのα位のアルキル化などによる方法も知られている。不斉合成に関しても様々な手法が提案されている(ストレッカー反応の項目なども参照)。
工業的には、微生物を用いたアミノ酸発酵によって大量に合成されている。人工的に突然変異させた微生物株を、炭素源となる糖類や窒素源となる硫酸アンモニウムと共に培養することで、安価に目的のアミノ酸が合成できる[11]。
摂取状況
- 米国
米国医学研究所の書籍(2005)[5]では以下のようになっている。
| アミノ酸 | グラム/日 | mM/日 |
|---|---|---|
| アラニン | 3.64 | 40.8 |
| アルギニン | 4.18 | 23.9 |
| アスパラギン酸 | 6.54 | 49.5 |
| システイン | 1.01 | 8.3 |
| グルタミン酸 | 15.27 | 103.7 |
| グリシン | 3.21 | 42.7 |
| ヒスチジン | 2.20 | 14.1 |
| イソロイシン | 3.55 | 27.0 |
| ロイシン | 6.10 | 46.5 |
| リジン | 5.27 | 36.0 |
| メチオニン | 1.77 | 11.8 |
| フェニルアラニン | 3.40 | 20.5 |
| プロリン | 5.21 | 45.2 |
| セリン | 3.52 | 33.4 |
| トレオニン | 3.02 | 25.3 |
| トリプトファン | 0.91 | 4.4 |
| チロシン | 2.79 | 15.3 |
| バリン | 3.99 | 34.0 |
サプリメント
近年(2006年現在)はアミノ酸を含有するサプリメントが日本の消費者に一種の健康ブームを引き起こしており、健康食品、飲料メーカーなどが盛んに新製品を出している。しかし、そのアミノ酸の成分のバランスが人間に必要な量通りに研究され、配合されているかは不明確である。
関連項目
- 必須アミノ酸
- アミノ酸の代謝分解
- ニンヒドリン反応
- コドン
- ペプチド結合
- スティックランド反応
脚注
^ 1958-, Berg, Jeremy M. (Jeremy Mark), (2012). Biochemistry. Tymoczko, John L., 1948-, Stryer, Lubert. (7th ed ed.). New York: W.H. Freeman. ISBN 9781429229364. OCLC 758952268. https://www.worldcat.org/oclc/758952268.
^ L., Lehninger, Albert (2000). Lehninger principles of biochemistry.. Nelson, David L. (David Lee), 1942-, Cox, Michael M. (3rd ed. ed.). New York: Worth Publishers. ISBN 1572591536. OCLC 42619569. https://www.worldcat.org/oclc/42619569.
- ^ ab“アミノ酸大百科 - アミノ酸は私たちの生命の源”. 2018年7月21日閲覧。
^ Reeds, P. J. (2000-7). “Dispensable and indispensable amino acids for humans”. The Journal of Nutrition 130 (7): 1835S–40S. doi:10.1093/jn/130.7.1835S. ISSN 0022-3166. PMID 10867060. https://www.ncbi.nlm.nih.gov/pubmed/10867060.
- ^ abInstitute of Medicine (2005). “10. Protein and Amino Acids”. Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids. The National Academies Press. pp. 593(Table 10-1). https://www.nap.edu/read/10490/chapter/12#593.
^ Kozlowski, Lukasz P. (2017-01-04). “Proteome-pI: proteome isoelectric point database”. Nucleic Acids Research 45 (D1): D1112–D1116. doi:10.1093/nar/gkw978. ISSN 1362-4962. PMC PMC5210655. PMID 27789699. https://www.ncbi.nlm.nih.gov/pubmed/27789699.
^ Khoury, George A.; Baliban, Richard C.; Floudas, Christodoulos A. (2011-09-13). “Proteome-wide post-translational modification statistics: frequency analysis and curation of the swiss-prot database”. Scientific Reports 1. doi:10.1038/srep00090. ISSN 2045-2322. PMC PMC3201773. PMID 22034591. https://www.ncbi.nlm.nih.gov/pubmed/22034591.
^ Donald., Voet, (2006). Fundamentals of biochemistry : life at the molecular level. Voet, Judith G., Pratt, Charlotte W. (2nd ed ed.). New York: Wiley. ISBN 9780471214953. OCLC 58845396. https://www.worldcat.org/oclc/58845396.
^ Miller, S. L. (1953-05-15). “A production of amino acids under possible primitive earth conditions”. Science (New York, N.Y.) 117 (3046): 528–529. ISSN 0036-8075. PMID 13056598. https://www.ncbi.nlm.nih.gov/pubmed/13056598.
^ Miller, S. L.; Urey, H. C. (1959-07-31). “Organic compound synthesis on the primitive earth”. Science (New York, N.Y.) 130 (3370): 245–251. ISSN 0036-8075. PMID 13668555. https://www.ncbi.nlm.nih.gov/pubmed/13668555.
^ Leuchtenberger, Wolfgang; Huthmacher, Klaus; Drauz, Karlheinz (2005-11). “Biotechnological production of amino acids and derivatives: current status and prospects”. Applied Microbiology and Biotechnology 69 (1): 1–8. doi:10.1007/s00253-005-0155-y. ISSN 0175-7598. PMID 16195792. https://www.ncbi.nlm.nih.gov/pubmed/16195792.
^ Appendix D,
Dietary Reference Intakes for Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids (2005)
Chapter: D Dietary Intake Data from the Third National Health and Nutrition Examination Survey (NHANES III), 1988–1994
| |||||||||||||||||||||||
