硫酸
| 硫酸 | |
|---|---|
 | |
 | |
 | |
IUPAC名 Sulfuric acid | |
| 識別情報 | |
CAS登録番号 | 7664-93-9 |
EC番号 | 231-639-5 |
E番号 | E513 (pH調整剤、固化防止剤) |
国連/北米番号 | |
RTECS番号 | WS5600000 |
| 特性 | |
化学式 | H2SO4 |
モル質量 | 98.08 g mol−1 |
| 外観 | 無色の油状液体 |
密度 | 1.84 g cm−3, 液体 |
融点 | 10 °C, 283 K, 50 °F |
沸点 | 290 °C, 563 K, 554 °F |
水への溶解度 | 任意に混和 |
酸解離定数 pKa | −3 |
粘度 | 26.7 cP (20 °C) |
| 熱化学 | |
標準生成熱 ΔfH | −813.989 kJ mol−1 |
標準モルエントロピー S | 156.904 J mol−1K−1 |
標準定圧モル比熱, Cp | 138.91 J mol−1K−1 |
| 危険性 | |
安全データシート(外部リンク) | ICSC 0362 |
GHSシグナルワード | 危険 / Danger |
Hフレーズ | H314 |
EU分類 | 腐食性 (C) |
| EU Index | 016-020-00-8 |
NFPA 704 |  0 3 2 |
Rフレーズ | R35 |
Sフレーズ | S1/2 S26 S30 S45 |
引火点 | 不燃性 |
| 関連する物質 | |
| 関連する強酸 | セレン酸 塩酸 硝酸 |
| 関連物質 | 発煙硫酸 二酸化硫黄 三酸化硫黄 ペルオキソ一硫酸 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
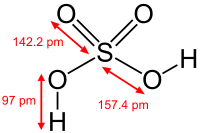
硫酸(りゅうさん、英: sulfuric acid)は、化学式 H2SO4 で示される無色、酸性の液体で硫黄のオキソ酸の一種である。古くは緑礬油(りょくばんゆ)とも呼ばれた。化学薬品として最も大量に生産されている。
硫酸の性質は濃度と温度によって大きく異なる。濃度の低い硫酸(質量パーセント濃度が約90%未満)水溶液を希硫酸(きりゅうさん)という。希硫酸は強酸性だが酸化力や脱水作用はない。濃度の高い硫酸(質量パーセント濃度が約90%以上)を濃硫酸(のうりゅうさん)といい強力な酸化力や脱水作用を有し、濃硫酸のハメットの酸度関数は96%では H0 = −9.88 であり、98%では H0 = −10.27 の強酸性媒体である[1]。
市販の濃硫酸は96〜98%程度のものが多く、96% (d = 1.831 g cm−3) のものでモル濃度は18 mol dm−3、規定度は36Nである。濃硫酸を体積で6倍に希釈した希硫酸は、モル濃度は3 mol dm−3、規定度は6Nであり、質量パーセント濃度は25% (d = 1.175g cm−3)、H0 = −1.47 であり、10%を超え含有する溶液は医薬用外劇物の指定を受ける。
おもに工業用品、医薬品、肥料、爆薬などの製造や、鉛蓄電池などの電解液に用いる。
目次
1 化学的性質
1.1 硫酸の水和
1.2 金属に対する反応
1.3 有機物に対する求電子置換反応
1.4 純硫酸中の平衡
1.5 水溶液中の電離平衡
1.5.1 第一解離定数
1.5.2 第二解離定数
2 物理的性質
3 歴史
3.1 イスラム錬金術
3.2 産業革命
4 日本国内の製造史
5 工業的製法
6 硫酸の生産能力
7 用途
8 硫酸イオン
9 硫酸水素イオン
10 硫酸塩
10.1 硫酸水素塩
10.2 硫酸塩鉱物
11 硫酸エステル
12 硫酸に因む地名
13 脚注・参考文献
14 関連項目
15 外部リンク
化学的性質
硫酸は三酸化硫黄 (SO3) を水と反応させて得られる、やや粘性のある酸性の液体である。
塩酸などとは異なり不揮発性であるため、濃度の低い硫酸であっても水分が蒸発すると濃縮されるので、衣服に付いた場合などは、そのまま放置すると穴が開く危険性があり、また、皮膚に付いたものを放置すると、火傷をする恐れがある。
硫酸の水和
水分子との強い親和力により吸湿性と強い脱水作用があり、有機化合物から水素と酸素を水分子の形で引き抜く。ショ糖に濃硫酸をかけると炭化したり、濃硫酸が皮膚に付くと火傷を起こすのは、この脱水作用と発熱およびプロトン化能力のためである。
硫酸の水和熱は極めて大きく第一水和エンタルピー変化は以下の通りである[2]。
H2SO4(l)+H2O(l)↽−−⇀H2SO4⋅H2O(l){displaystyle {ce {H2SO4(l) + H2O(l) <=> H2SO4 . H2O(l)}}}, ΔH∘=−27.80 kJ mol−1{displaystyle Delta H^{circ }=-27.80~mathrm {kJ~mol} ^{-1}}
また硫酸の溶解エンタルピー変化は以下の通りである。
H2SO4(l)↽−−⇀H+(aq)+HSO4−(aq){displaystyle {ce {H2SO4(l) <=> H^+ (aq) + HSO4^- (aq)}}}, ΔH∘=−73.35 kJ mol−1{displaystyle Delta H^{circ }=-73.35~mathrm {kJ~mol} ^{-1}}
このため濃硫酸を希釈する場合は、発熱に注意しながら、撹拌して水に少しずつ濃硫酸を加えていかなければならない。
水に溶かすと発熱するが、氷と混ぜると多くの水溶性化合物に見られるように、逆に寒剤ともなり得る。
金属に対する反応
金属と反応させた場合の挙動は、金属の種類のほか、硫酸の濃度と温度に依存する。例えば濃度と温度がいずれも高い熱濃硫酸では、酸化力が高くなる。
反応生成物も変化に富む。一般には、水素 (H2)、硫化水素 (H2S)、硫黄 (S)、二酸化硫黄 (SO2)、金属の硫化物、硫酸塩が生成する。
希硫酸は水素よりイオン化傾向の大きな金属と反応し水素を発生させる。ただし、鉛は表面に不溶性の硫酸鉛を生じ反応が進行しない。スズ、ニッケルなどとの反応も極めて遅い。亜鉛との反応は実験室で手軽に水素ガスを発生させる方法として用いられる。
- H2SO4+Zn⟶ZnSO4+H2{displaystyle {ce {H2SO4 + Zn -> ZnSO4 + H2}}}
濃硫酸を加熱したものを熱濃硫酸(ねつのうりゅうさん)という。290℃以上では濃硫酸は水と三酸化硫黄に分解し、三酸化硫黄は酸化力を持ち、これ以下の温度でも平衡混合物として三酸化硫黄が存在する。そのため熱濃硫酸には強い酸化力があり、酸化剤として用いられる。イオン化傾向の小さい銅や銀などとも反応する。また炭素、硫黄などの非金属とも反応する。
例えば熱濃硫酸と銀との化学反応式は以下のようになる。
- 3H2SO4+2Ag→Δ2AgHSO4+SO2+2H2O{displaystyle {ce {3H2SO4 + 2Ag ->[Delta] 2AgHSO4 + SO2 + 2H2O}}}
有機物に対する求電子置換反応
熱濃硫酸は芳香族化合物などの有機物とスルホン化反応を起こす(ただし発煙硫酸を使う方法のほうが一般的である)。これは平衡生成物として僅かに存在しているSO₃による求電子置換反応である。この反応により生成するスルホン酸(RSO3H)は1価の強酸である。

ベンゼンのスルホン化反応
濃硝酸と濃硫酸を混合した混酸は、有機物とニトロ化反応を起こし、グリセリンなどアルコールと反応して硝酸エステルを生成する。これも強酸性媒体である濃硫酸中で硝酸がプロトン化を受け続いて脱水した結果生成したニトロイルイオン(nitroyl / NO+
2)による求電子置換反応である。
純硫酸中の平衡
純硫酸は濃硫酸に計算量の三酸化硫黄または発煙硫酸を反応させて得られるが、これを加熱するとやはり290 ℃以上で分解が始まり、さらに加熱により98.33%の水溶液となり、沸点338 ℃の共沸混合物となる。
| 重量% | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 99.44 |
|---|---|---|---|---|---|---|---|---|---|---|
| H0 | −0.31 | −1.01 | −1.72 | −2.41 | −3.38 | −4.46 | −5.8 | −7.34 | −8.92 | −11.21 |
濃硫酸、とくに100%の純硫酸であっても分子性の液体としては比較的高度に電離しており[4]、水素イオン(実際にはH3SO+
4)は10-2mol kg−1程度生成し、また溶媒としての硫酸は溶質にプロトン(水素イオン)を供与する力が非常に強くハメットの酸度関数ではH0 = −11.94を示す[1]。しかし酸度関数も濃度により変化する。
プロトン性極性溶媒である純硫酸には自己解離および縮合などの平衡が存在し10 ℃の平衡定数は以下の通りである[5]。
2H2SO4⟶H3SO4++HSO4−{displaystyle {ce {2H2SO4 -> H3SO4^+ + HSO4^-}}} , K=1.7×10−4 mol2 kg−2{displaystyle K=1.7times 10^{-4}~mathrm {mol} ^{2}~mathrm {kg} ^{-2}}
2H2SO4⟶H3O++HS2O7−{displaystyle {ce {2H2SO4 -> H3O^+ + HS2O7^-}}} , K=3.5×10−5 mol2 kg−2{displaystyle K=3.5times 10^{-5}~mathrm {mol} ^{2}~mathrm {kg} ^{-2}}
H2O+H2SO4⟶H3O++HSO4−{displaystyle {ce {H2O + H2SO4 -> H3O^+ + HSO4^-}}}, K=1 mol kg−1{displaystyle K=1~mathrm {mol~kg} ^{-1},}
H2SO4+H2S2O7⟶H3SO4++HS2O7−{displaystyle {ce {H2SO4 + H2S2O7 -> H3SO4^+ + HS2O7^-}}}, K=7×10−2mol kg−1{displaystyle K=7times 10^{-2}mathrm {mol~kg} ^{-1}}
平衡にある純硫酸中の化学種の濃度はH3SO+
4(1.13×10-2 mol kg-1), HSO−
4(1.50×10-2 mol kg-1), H3O+(8.0×10-3 mol kg-1), HS2O+
7(4.4×10-3 mol kg−1), H2S2O7(3.6×10-3 mol kg-1), H2O(1×10-4 mol kg-1)であり[6]、分子性の液体としてはかなり高い電気伝導度を示し、25℃における比電気伝導度は1.044×10-2 Ω-1 cm-1である。
この電気伝導度の値は純硝酸の3.72×10-2 Ω-1 cm-1(25℃)よりは低いものの、フルオロ硫酸の1.085×10-4 Ω-1 cm-1(25℃)、純フッ化水素の1.6×10-6 Ω-1 cm-1(0℃)、および純水の6.40×10-8 Ω-1 cm-1(25℃)よりもはるかに高い[5]。
水溶液中の電離平衡
硫酸は水溶液中では強い二塩基酸として働き、一段目はほぼ完全解離、二段目はやや不完全となる。2価の酸であっても塩基水溶液による水溶液中の中和滴定曲線は1価の強酸と類似の形状を示し第一当量点は現れない。
その酸解離定数(熱力学的定数)は25 ℃において以下の通りである[1][7]。ここで [X]{displaystyle {[mathrm {X} ]},} は X{displaystyle {mathrm {X} },} の活量を表すが、希薄水溶液では質量モル濃度(モル濃度にもほぼ漸近する)に近い。

水酸化ナトリウム水溶液による中和滴定曲線
第一解離定数
- H2SO4(aq) ⇌ H+(aq)+HSO4−(aq){displaystyle {rm {H_{2}SO_{4}(aq) rightleftharpoons H^{+}(aq)+HSO_{4}^{-}(aq)}}}
- Ka1=[H+][HSO4−][H2SO4]=105{displaystyle K_{a1}={frac {[{mbox{H}}^{+}][{mbox{HSO}}_{4}^{-}]}{[{mbox{H}}_{2}{mbox{SO}}_{4}]}}=10^{5}}
- pKa1=−5{displaystyle mathrm {p} K_{a1}=-5,}
第二解離定数
- HSO4−(aq) ⇌ H+(aq)+SO42−(aq){displaystyle {rm {HSO_{4}^{-}(aq) rightleftharpoons H^{+}(aq)+SO_{4}^{2-}(aq)}}}
- Ka2=[H+][SO42−][HSO4−]=1.02×10−2{displaystyle K_{a2}={frac {[{mbox{H}}^{+}][{mbox{SO}}_{4}^{2-}]}{[{mbox{HSO}}_{4}^{-}]}}=1.02times 10^{-2}}
- pKa2=1.99{displaystyle mathrm {p} K_{a2}=1.99,}
二段階目の解離に関するエンタルピー変化、ギブスの自由エネルギー変化、エントロピー変化および定圧モル比熱変化は以下の通りである[2]。解離に伴うエントロピーの減少は、イオンの電荷の増加に伴う水和の程度の増加に起因する。
ΔH∘{displaystyle Delta H^{circ }} | ΔG∘{displaystyle Delta G^{circ }} | ΔS∘{displaystyle Delta S^{circ }} | ΔCp∘{displaystyle Delta Cp^{circ }} | |
|---|---|---|---|---|
| 第二解離 | −21.93 kJ mol−1 | 11.38 kJ mol−1 | −111.7 J mol−1 K−1 | −209 J mol−1 K−1 |
物理的性質
濃度98%の硫酸の融点は3 ℃、比重は1.84 (15 ℃) である。204 ℃、98.33%の濃度で水と三酸化硫黄の分圧が等しくなるため、不揮発性ではあるが、温度を上げるだけではこれ以上濃度を高めることはできない。
濃度が高くなるにつれ、油状になる。硫酸の粘度 (Pa s) は多くの液体で見られる通り温度の上昇とともに下がっていき、25 ℃、1気圧では、23.8×10-3であるが、50 ℃で11.7×10-3、100 ℃では4.1×10-3となる。しかし、ヒドロキシ基により強い水素結合が生成されるため[1]、粘度は水の数十倍にもなる[8]。
純硫酸の25 ℃における比誘電率は101であり、イオン解離に有利な溶媒であるといえる[4]。
歴史
イスラム錬金術
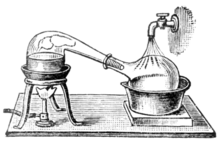
アランビック蒸留器
硫酸を発見した人物として2人の名前が知られている。1人は8世紀のイスラム世界の錬金術師、ジャービル・イブン=ハイヤーン(ラテン名ゲベルGeber)であり、ミョウバンもしくは緑礬(りょくばん、硫酸鉄(II) 7水和物を主体とする鉱石)を乾留して硫酸を得たとされている。もう1人は9世紀のイスラム社会の医者であり錬金術師であったイプン・ザカリア・アル・ラーズィー (ラテン名ラーゼスRhases) である。緑礬あるいは胆礬(硫酸銅(II)5水和物を主体とする鉱石)を乾留して硫酸を発見した。いずれにせよ乾留の過程で、熱分解によって酸化鉄(III)あるいは酸化銅(II)とともに三酸化硫黄が生じる。これが水を吸って凝縮し、希硫酸が得られた。
この方法は、13世紀のドイツ人アルベルト・マグナスなどによるイスラム文献の翻訳により、ヨーロッパへと伝えられた。このような由来により中世の錬金術師の間では、硫酸は礬油(oleum vitrioli)・礬精(spiritus vitrioli)と呼ばれていた。
14世紀には、ベネディクト会の修道士であり、錬金術学者でもあったバレンティヌス (Basilius Valentinus) が硫黄と硝石を併せて燃焼させると、金属を溶かす性質のある液体(硫酸)が得られることを発見した。
1600年ごろ、オランダ人の発明家コルネリウス・ドレベル (Cornelius Jacobszoon Drebbel) は、熱したイオウと硝石から当時としては最も効率よく硫酸を回収する方法を確立した。ドレベルの手法は150年後に登場するローバックの鉛室法につながっていった。
17世紀にはドイツの化学者ヨハン・ルドルフ・グラウバー (Johann Rudolph Glauber) がアムステルダムに硫酸工場を設立している。水蒸気を通じながら、硫黄を硝石と一緒に燃やす手法を採った。硝石の分解生成物が硫黄を酸化して三酸化イオウを作り、三酸化イオウと水の化合物として硫酸を得ていた。硫酸工場の目的は、硝石と反応させて硝酸を製造するためであった。1654年には食塩に硫酸を反応させて塩酸を発見している。このとき生成する硫酸ナトリウムは彼の名からグラウバー塩とも呼ばれる。
産業革命
1736年には、イギリスのジョシュア・ウォード (Joshua Ward) が全工程にガラス容器を用い、グラウバーの製法を用いて生産規模を拡大した。
1746年にイギリスの化学技術者ジョン・ローバック (John Roebuck) が反応容器の素材をそれまでのガラスから鉛に変え、鉛室法の基礎を確立した。硫酸の製造コストを大幅に引き下げることができたため、鉛室法の工場はイギリス中に広まった。繊維の漂白剤の製造に硫酸が欠かせなかったことから、17世紀から18世紀当時の産業革命の進展に大いに寄与した。
1793年、フランスの化学者ニコラ・クレマン (Nicolas Clement) とシャルル・デゾルム (Charles Bernard Désormes) が鉛室法を完成した。鉛の容器中で硫黄と硝石に「空気を通じながら」燃焼させたことに特徴がある。クレマンとデゾルムは、1811年にヨウ素を発見した化学工業家ベルナール・クールトアの友人であり、ヨウ素のサンプルの分析を依頼されて発見を再確認し、1813年11月29日にクールトアの業績を公開している。
その後、鉛室の前段階で硫黄を燃焼させ、三酸化硫黄を製造する工程が発明された。
1818年、フランスの物理学者、化学者であるゲイ=リュサックが鉛室法を改良、1827年には、鉛室で生成した窒素酸化物を回収するため、鉛室の後段に接続するゲイ=リュサック塔を考案した。1837年にはフランスの硫酸工場に最初の塔が設置されたものの、広範囲には使われなかった。
1859年には、イギリスのジョン・グローバー (John Glover) が回収した不純物を含む硫酸から硝酸を分離するためのグローバー塔を考案した。ゲイ=リュサック塔はグローバー塔と組み合わせることで真価を発揮し、硝酸法の地位が確立した。これをもって、硫酸製造の工業化が完成されたとされている。イオウの燃焼室、グローバー塔、鉛室、ゲイ=リュサック塔を直列に接続し、グローバー塔とゲイ=リュサック塔の間で硫酸を循環させるシステムができあがった。
1870年代には、鉛室の前後に2種類の塔を備えた硫酸工場がイギリスを中心にヨーロッパ中に広まった。
鉛室法は長い間標準的な製法であったが、白金触媒を用いる接触法が開発され、ついで、1915年に発見された五酸化二バナジウム (V2O5) 触媒を用いるBASF法に置き換えられていった。
日本国内の製造史
国内最初の硫酸製造工場は、1872年5月20日(旧暦明治5年4月14日)、大阪市北区天満にある大阪造幣局に設置された。大阪造幣局創設の翌年である。貨幣に利用する金銀合金の分離精製、および円形(えんぎょう/金属板を貨幣の形に打ち抜いたもの)の洗浄に用いるためである。当時の製造設備は硝酸法の一種である鉛室式であり、製造能力は1日当たり、180キログラムであった[9]。
硝酸法のもう一つの製造方法である接触法の製造設備は日露戦争中である1905年に登場した。設置場所は、神奈川県平塚市にあった平塚海軍火薬廠である。製造能力は1日当たり、3,000キログラムであった。
工業的製法
硫酸の原料は二酸化硫黄 (SO2) である。日本国内では原料の二酸化硫黄を銅などの非鉄金属の製錬副産物、黄鉄鉱などの焙焼(現在日本国内では行われていない)、もしくは石油の脱硫による回収硫黄から得ている。
- 2FeCuS2+SiO2+5O2⟶Δ2Cu+Fe2SiO4+4SO2{displaystyle {ce {2FeCuS2 + SiO2 + 5O2 {overset {Delta}{->}}2Cu + Fe2SiO4 + 4SO2}}}
- 4FeS2+11O2⟶Δ2Fe2O3+8SO2{displaystyle {ce {4FeS2 + 11O2 {overset {Delta}{->}}2Fe2O3 + 8SO2}}}
硫酸は二酸化硫黄を酸化し水と反応させることで製造されている。
酸化の方法は大きく接触法と硝酸法に分かれる。歴史的には窒素酸化物を触媒とする硝酸式(代表的なものは鉛室法)で製造されてきたが、製造できる硫酸の濃度が低く、装置とくに鉛室の鉛に起因する不純物も多くなってしまう。2004年現在、日本国内ではすべて接触法で硫酸を製造している。
接触法では、二酸化硫黄を酸化するために五酸化二バナジウムを表面に付着させたペレットやタブレットを用いる(触媒の失活を抑えるための添加物に特色があり、各種触媒が開発された)[10]。固体触媒を使い二酸化硫黄ガスを直接酸化させるため不純物の少ない三酸化硫黄(無水硫酸)が得られる。
- 2SO2+O2⟶2SO3{displaystyle {ce {2SO2 + O2 -> 2SO3}}}
三酸化硫黄と水との反応はあまりにも激しく、生成物が飛散しやすいため、吸収塔内で反応生成物である三酸化硫黄を濃硫酸に過剰に吸収させて発煙硫酸 (H2SO4·nSO3) とし、純水の希釈水で最終製品である93%、95 %、98 %の濃硫酸を得る。出来た濃硫酸はプロセスに戻し三酸化硫黄の溶媒として用いるほか、原料ガスの脱水にも用いられる[11]
- H2SO4⋅nSO3+nH2O⟶(n+1)H2SO4{displaystyle {ce {H2SO4 . nSO3 + nH2O -> (n + 1)H2SO4}}}
補足1: 三酸化硫黄は水とは発熱を伴って激しく反応し、硫酸を生じる。その化学反応式を以下に示す。
- SO3+H2O⟶H2SO4{displaystyle {ce {SO3 + H2O -> H2SO4}}}
補足2: 二酸化硫黄を二酸化窒素により酸化する硝酸法による硫酸製造の反応式。
- SO2+NO2⟶SO3+NO{displaystyle {ce {SO2 + NO2 -> SO3 + NO}}}
補足3: 過酸化水素による方法
- SO2+H2O2⟶H2SO4{displaystyle {ce {SO2 + H2O2 -> H2SO4}}}
硫酸の生産能力
硫酸はさまざまな肥料、繊維、薬品の製造に不可欠である。そのため、硫酸の生産能力は、一国の化学産業の指標となっている。2000年現在の年間生産量では、全世界の9600万トンのうち、中国が2400万トンを占める。次いで、アメリカ合衆国の960万トン、ロシアの830万トン、日本の710万トン、インドの550万トンである。中国とインドは5年間で生産量を約30%伸ばしており、ロシアも成長しているが、日本は微増にとどまり、アメリカ合衆国は減少している。
2016年度日本国内生産量は 6,460,710t、消費量は 762,555t である[12]。
用途

鉛蓄電池
硫酸を原料(実際には発煙硫酸と塩化水素から製造したクロロスルホン酸を反応に用いる)に合成される直鎖アルキルベンゼンスルホン酸ナトリウム(RC6H4SO3Na)および高級アルコールの硫酸モノエステルのナトリウム塩であるラウリル硫酸ナトリウム(CH3(CH2)11OSO3Na)は合成洗剤、シャンプーおよび歯磨き粉などの界面活性剤として用いられる。多数のスルホ基(-SO3H)を有する高分子は陽イオン交換樹脂として、イオン交換膜および水の精製などに用いられる。酸触媒としてはニトロ化合物製造の反応助剤として重要な役割を持つ。
また安価な強酸であることから希硫酸は、デンプンの糖化による水飴の製造、臭素およびヨウ素の製造、紡績、金属の電解精錬用の電解液としても用いられる。鉛蓄電池の電解液としては濃度約33%(d=1.24 g cm−3)の希硫酸が用いられ、放電に伴い濃度は低下する。
肥料としては硫安、過リン酸石灰の製造原料として大量に消費される。紙を濃硫酸で処理した半透明の薄い紙は硫酸紙と呼ばれ、羊皮紙の代用として用いられる[13]。
硫酸イオン


硫酸イオン(りゅうさんいおん、sulfate, SO2−
4)は主に硫酸およびその化合物の電離、分解などによって生成する2価の陰イオンで硫酸塩結晶中にも存在する、硫黄化合物である。
正四面体型構造で、硫酸ヒドラジニウム(N₂H₆SO₄)結晶中のS-O結合距離は149pmであり、単結合と二重結合の中間的な長さに相当する。このS-O間の共有結合に関しては、当初はs、p軌道に加えd軌道も混じった混成であるという意見や(これはd軌道のエネルギーの高さから、SF6の場合と同様早期に否定的な意見が出ている)、酸素原子上の非共有電子対のバックドネーション的な効果が提唱されていたものの、実験と理論の両面からの検討により単結合と捉えるのが妥当であることが判明した[14]。なお単なる単結合より結合距離が短い点に関しては、酸素原子と硫黄原子上にそれぞれ−1.5と+4価程度の電荷が存在すること、共有結合そのものも分極が強く電荷にかなりの偏りがあることにより、S-O間に共有結合に加えクーロン力(イオン結合的な力)が働いているためである。
硫酸は強い酸化剤となるため、イオン化傾向の低い金属などにも作用し、硫酸イオンを含む多くの金属の化合物を作る。硫酸イオンより酸素原子が1つ少ないイオン (SO2−
3) は亜硫酸イオンと呼ばれる。
金属イオンに対する配位結合は弱いほうであるが、コバルト(III)イオンなどに対してはスルファト錯体(sulfato)を形成する。
- [Co(NH3)5(H2O)]3++SO42− ⇌ [Co(SO4)(NH3)5]++H2O{displaystyle {rm {[Co(NH_{3})_{5}(H_{2}O)]^{3+}+SO_{4}^{2-} rightleftharpoons [Co(SO_{4})(NH_{3})_{5}]^{+}+H_{2}O}}}
海水中にもかなり多量に溶存し、その濃度は2.8 g dm−3、0.029 mol dm−3と陰イオンとしては塩化物イオンに次いで多量に存在する。
硫酸水素イオン

硫酸水素イオン(りゅうさんすいそいおん、hydrogensulfate, HSO4−)は硫酸の一段階目の電離により生成し、また硫酸水素塩の結晶中に存在する1価の陰イオンであり、やや歪んだ四面体型構造で、水素原子が結合したO-S結合距離がやや長い。
希硫酸中には硫酸イオンは寧ろ低濃度でしか存在せず陰イオンの多くは硫酸水素イオンとして存在し、硫酸濃度を10−2 mol dm−3程度以下に希釈をして初めて硫酸イオンが主な化学種となる。
たとえばラマンスペクトルによる結果では3.5 mol kg−1 (3.07 mol dm−3)の希硫酸ではHSO4−が2.06 mol dm−3、SO42−が1.01 mol dm−3である[15]。
硫酸塩
 硫酸鉄(II)七水和物  硫酸銅(II)五水和物  クロムミョウバン |
硫酸は安価に製造できる不揮発性の強酸のため、種々の硫酸塩が工業製品として製造されている。
硫酸イオンを含むイオン結晶であり多くのものは水溶性であるが、アルカリ土類金属塩(CaSO4, SrSO4, BaSO4, RaSO4)、鉛塩(PbSO4)および銀塩(Ag2SO4) は難溶性であり、バリウム塩およびラジウム塩は特に溶解度が低い。本来硫酸イオンは無色透明であるが遷移金属イオンを含むものは様々な色を呈する。(記事 硫酸塩も参照のこと)
硫酸亜鉛 (ZnSO4) – 七水和物は皓礬(こうばん)
硫酸アルミニウム (Al2(SO4)3)- 硫酸アルミニウムカリウム (AlK(SO4)2·12H2O) – 最も一般的なミョウバン
硫酸アンモニウム ((NH4)2SO4) – 硫安、肥料として用いられる
硫酸カリウム (K2SO4) – 肥料
硫酸カルシウム (CaSO4) – 石膏の主成分
硫酸銀 (Ag2SO4)
硫酸クロムカリウム (CrK(SO4)2·12H2O) – クロムミョウバン
硫酸タリウム (Tl2SO4) – 殺鼠剤の有効成分
硫酸鉄(II) (FeSO4) – 七水和物は緑礬
硫酸鉄(III) (Fe2(SO4)3)
硫酸銅(I) (Cu2SO4)
硫酸銅(II) (CuSO4) – 五水和物は胆礬
硫酸ナトリウム (Na2SO4) – 芒硝(ぼうしょう)
硫酸鉛 (PbSO4) – 鉛蓄電池の電極
硫酸ニッケル (NiSO4)
硫酸バリウム (BaSO4) – 造影剤
硫酸マグネシウム (MgSO4) – 瀉利塩(しゃりえん、Epsom salt)
硫酸水素塩
硫酸水素塩(りゅうさんすいそえん、hydrogensulfate)は硫酸水素イオン(HSO4−)を含むイオン結晶で、水素塩(酸性塩)の一種であり、広義には硫酸塩に含まれる。重硫酸塩(じゅうりゅうさんえん、bisulfate)、酸性硫酸塩(さんせいりゅうさんえん、acid sulfate)などと呼ばれることもあるが正式名称ではない。多くのものが吸湿性で水に易溶であり、水溶液は硫酸水素イオンの電離のため酸性を示す。
硫酸水素塩はアルカリ金属塩(MIHSO4)が硫酸塩と硫酸の等モル混合水溶液の濃縮により得られ比較的安定であり、加熱により脱水し二硫酸塩(MI2S2O7)となる。難溶性塩の酸性融解の融剤あるいは白金坩堝などの洗浄に用いられる。
アルカリ土類金属塩、鉛塩(MII(HSO4)2)などは硫酸塩を熱濃硫酸に溶解し冷却すると得られるが、吸湿により硫酸塩と硫酸に分解しやすい[13]。
また硫酸一水和物H2SO4·H2Oは濃硫酸に計算量の水を加えて冷却すると結晶として得られ、融点は8.5℃であり固体(H3O+·HSO4−)はオキソニウムイオンと硫酸水素イオンからなるイオン結晶である。
硫酸水素アンモニウム (NH4HSO4)
硫酸水素カリウム (KHSO4)
硫酸水素カルシウム (Ca(HSO4)2)
硫酸水素ナトリウム (NaHSO4)
硫酸水素ニトロシル (NOHSO4) – ニトロソ化試薬
硫酸塩鉱物
透石膏  天青石 |
鉱物学において、硫酸塩からなる鉱物を硫酸塩鉱物(りゅうさんえんこうぶつ、sulfate mineral)という。硫化鉱物の酸化および熱水からの析出などにより生成し、以下のようなものがある。
明礬石, Alunite(KAl3(SO4)2(OH)6)
マラー石, Mallardite(MnSO4·7H2O)
緑礬, Melanterite(FeSO4·7H2O)
赤礬, Bieberite(CoSO4·7H2O)
亜鉛緑礬, Zinc-melanterite((Zn,Mn,Mg,Fe)SO4·7H2O)
胆礬, Chalcanthite(CuSO4·5H2O)
石膏, Gypsum(CaSO4·2H2O)
硬石膏, Anhydrite(CaSO4)
天青石, Celestite(SrSO4)
重晶石, Barite(BaSO4)
硫酸鉛鉱, Anglesite(PbSO4)
北投石, Hokutolite((Ba,Pb)SO4)
硫酸エステル
硫酸とアルコールとが脱水縮合した構造を持つ誘導体を示す。モノエステル(ROSO2OH)およびジエステル((RO)2SO2)が存在し、モノエステルは1価の強酸である。
硫酸ジメチル ((CH3O)2SO2) – メチル化試薬
硫酸に因む地名

硫酸町バス停
- 硫酸町(りゅうさんまち 山口県山陽小野田市小野田)
日産化学工業小野田工場に由来。かつては硫酸町商店街もあった。現在「硫酸町」は通称地名の扱いだが、引き続き独自の郵便番号が割り振られている(〒756-0807)。国土用語の基礎知識 日本地理編も参照。- 硫酸町バス停(サンデン交通・船鉄バス)
脚注・参考文献
- ^ abcd田中元治 『基礎化学選書8 酸と塩基』 裳華房、1971年
- ^ abD.D. Wagman, W.H. Evans, V.B. Parker, R.H. Schumm, I. Halow, S.M. Bailey, K.L. Churney, R.I. Nuttal, K.L. Churney and R.I. Nuttal, The NBS tables of chemical thermodynamics properties, J. Phys. Chem. Ref. Data 11 Suppl. 2 (1982)
^ M.J.Jorgentson, D.R. Hatter, J. Am. Chem. Soc., vol.85,878(1963).
- ^ abシャロー 『溶液内の化学反応と平衡』 藤永太一郎、佐藤昌憲訳、丸善、1975年
- ^ ab F.A. コットン, G. ウィルキンソン著, 中原 勝儼訳 『コットン・ウィルキンソン無機化学』 培風館、1987年, 原書:F. ALBERT COTTON and GEOFFREY WILKINSON, Cotton and Wilkinson ADVANCED INORGANIC CHEMISTRY A COMPREHENSIVE TEXT Fourth Edition, INTERSCIENCE, 1980.
^ Greenwood, Norman N.; Earnshaw, A. (1997). Chemistry of the Elements, 2nd Edition, Oxford: Butterworth-Heinemann.
^ 湯川泰秀訳 『ストライトウィーザー有機化学解説(1)(第4版)』 広川書店、1995年
^ 国立天文台編『理科年表 平成25年』 p.388、丸善
^ 『造幣局百年史(資料編)』 大蔵省造幣局、1971年
^ https://www.shokubai.org/senior/News62.pdf 触媒懇談会ニュース No. 62 触媒学会シニア懇談会 January 1, 2014。2017年12月3日 閲覧 (PDF)
^ https://www.mes.co.jp/mes_technology/research/pdf/200_08.pdf 三井造船技報 No. 200(2010-6)。2017年12月3日 閲覧 (PDF)
^ 経済産業省生産動態統計年報 化学工業統計編
- ^ ab化学大辞典編集委員会 『化学大辞典』 共立出版、1993年
^ M. S. Schmøkel, S. Cenedese, J. Overgaard, M. R. V. Jørgensen, Y.-S. Chen, C. Gatti, D. Stalke and B. B. Iversen, Inorg. Chem., 51, 8607 (2012).
^ E. B. Robertson and H. B. Dunford, J. Am. Chem. Soc., 86, 5080 (1964).
関連項目
- 硫酸菌
- 混酸
- 二硫酸
- 亜硫酸
- 過硫酸
- ピラニア溶液
- 硫酸協会
外部リンク
硫酸 理科ねっとわーく(一般公開版) - 文部科学省 国立教育政策研究所
| ||||||||
| ||||||||





![{displaystyle {ce {3H2SO4 + 2Ag ->[Delta] 2AgHSO4 + SO2 + 2H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b8725b6ff4eb3ed746da57609a55383020ad8047)








![{[{mathrm {X}}]},](https://wikimedia.org/api/rest_v1/media/math/render/svg/793817f11e10297a418e4c1410b3065f1b7f42b5)


![K_{{a1}}={frac {[{mbox{H}}^{+}][{mbox{HSO}}_{4}^{-}]}{[{mbox{H}}_{2}{mbox{SO}}_{4}]}}=10^{{5}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b9ab4c04399128d86ef3675dd9f2e98f9c0af463)


![K_{{a2}}={frac {[{mbox{H}}^{+}][{mbox{SO}}_{4}^{{2-}}]}{[{mbox{HSO}}_{4}^{-}]}}=1.02times 10^{{-2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/36224c8279db89b15507edc14287758cfbff0026)












![{displaystyle {rm {[Co(NH_{3})_{5}(H_{2}O)]^{3+}+SO_{4}^{2-} rightleftharpoons [Co(SO_{4})(NH_{3})_{5}]^{+}+H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f905a684f7d112726cefc6abbdb86e54256ce22a)